class 10 NCERT/CBSE Science chapter-2-text book Question and Answer part -1 || Acids, Bases and Salts
Chapter-2
अम्ल ,क्षारक एवं लवण
प्रश्न-1. कोई विलयन लाल लिटमस पत्र को नीला कर देता है ,इसका PH संभवतः क्या होगा ?
अ) 1
ब) 4
स) 5
द) 10
उत्तर – द) 10
स्पष्टीकरण – अम्ल (PH < 7) (इनकी PH 7 से कम होती है ) नीले लिटमस पत्र को लाल कर देते है जबकि क्षार (PH > 7) (इनकी PH 7 से अधिक होती है ) लास लिटमस पत्र को नीला कर देते है । और जिन विलयनों की PH = 7 होती है उन्हें उदासीन विलयन कहते है ये किसी भी लिटमस को प्रभावित नहीं करते है ।
प्रश्न-2. कोई विलयन अंडे के पिसे हुए कवच से अभिक्रिया कर एक गैस उत्पन्न करता है जो चूने के पानी को दूधिया कर देती है । इस विलयन में क्या होगा ?
अ) NaCl
ब) HCl
स) LiCl
द) KCl
उत्तर – ब) HCl
स्पष्टीकरण – HCl अम्ल पीसे हुए अंडे के कवच (जो कैल्सियम कार्बोनेट = CaCO3 का बना होता है ) से अभिक्रिया कर CO2 गैस उत्पन्न करता है । जिसकी अभिक्रिया निम्न होती है –
2HCl + CaCO3 → CaCl2 + H2O + CO2
जब इस मुक्त CO2 को चूने के पानी Ca(OH)2 में प्रभावित करते है तो यह गैस चूने को पानी को दूधिया कर देती है । जिसमें निम्न अभिक्रिया होती है –
Ca(OH)2 + CO2 → CaCO3 (श्वेत अवक्षेप) + H2O
प्रश्न-3. NaOH का 10 mL , HCl के 8 mL विलयन से पूर्णतः उदासीन हो जाता है । यदि हम NaOH के उसी विलयन का 20 mL लें तो इसे उदासीन करने के लिए HCl के उसी विलयन की कितनी मात्रा की आवश्यकता होगी ?
अ) 4 mL
ब) 8 mL
स) 12 mL
द) 16 mL
उत्तर – द) 16 mL
स्पष्टीकरण – इस प्रकार की उदासीनकरण अभिक्रियाएँ जिनमें विलयनों की सांद्रताएँ समान रहती है और उदासीनीकरण अभिक्रिया में उपयोग आने वाले विलयनों की मात्राएँ ज्ञात करनी है तो इसकी लिए निम्न सूत्र होता है –
प्रश्न-4. अपच का उपचार करने के लिए निम्न में से किस औषधि का उपयोग करते है –
अ) एंटिबायोटिक (प्रतिजैविक)
ब) ऐनालजेसिक (पीड़ाहारी)
स) ऐन्टेसिड
द) एंटिसेप्टिक(प्रतिरोधी)
उत्तर – स) ऐन्टेसिड
स्पष्टीकरण – Chapter-2- Acids, Bases and Salts
प्रश्न-5. निम्न अभिक्रिया के लिए पहले शब्द समीकरण लिखिए तथा उसके बाद संतुलित समीकरण लिखिए –
a. तनु सल्फ्यूरिक अम्ल दानेदार जिंक के साथ अभिक्रिया करता है ।
b. तनु हाइड्रोक्लोरिक अम्ल मैग्निशियम पट्टी के साथ अभिक्रिया करता है ।
c. तनु सल्फयूरिक अम्ल एल्यूमिनियम चूर्ण के साथ अभिक्रिया करता है ।
d. तनु हाइड्रोक्लोरिक अम्ल लौह के रेतन के साथ अभिक्रिया करता है ।
उत्तर –
a) जिंक + तनु सल्फ्यूरिक अम्ल → जिंक सल्फेट + हाइड्रोजन गैस
Zn (s) + H2SO4 (aq) → ZnSO4 (aq) + H2 (g)
b) मैग्निशियम + तनु हाइड्रोक्लोरिक → मैग्निशियम क्लोराइड + हाइड्रोजन गैस
Mg (s) + 2HCl (aq) → MgCl2 (aq) + H2 (g)
c) एल्यूमिनियम + तनु सल्फयूरिक अम्ल → एल्यूमिनियम सल्फेट + हाइड्रोजन गैस
2Al (s) + 3H2SO4 (aq) → Al2(SO4)3 (aq) + 3H2 (g)
d) लौह + तनु हाइड्रोक्लोरिक अम्ल → आयरन क्लोराइड + हाइड्रोजन गैस
Fe (s) + 2HCl (aq) → FeCl2 (aq) + H2 (g)
प्रश्न-6. ऐल्कोहल एवं ग्लूकोज जैसे यौगिकों में भी हाइड्रोजन होते हैं लेकिन इनका वर्गीकरण अम्ल की तरह नहीं होता है । एक क्रियाकलाप द्वारा साबित कीजिए ।
उत्तर- ऐल्कोहल एवं ग्लूकोज जैसे यौगिकों में भी हाइड्रोजन होती है परन्तु ये विलयन में आयनीकृत नहीं होते है और H+ आयन उत्पन्न नहीं करते है । यह निम्न क्रियाकलाप से प्रदर्शित होता है –
1) ग्लूकोज, ऐल्कोहल, हाइड्रोक्लोरिक अम्ल ,सल्फ्यूरिक अम्ल आदि का विलयन लेते है ।
2) एक कॉर्क पर दो लौहे की कीलें लगाकर कॉर्क को 100 mL के एक बीकर में रख देते है ।
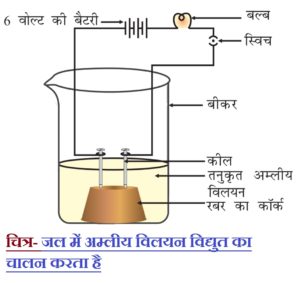
3) चित्र के अनुसार कीलों को 6 वोल्ट की एक बैट्री के दोनों टर्मिनलों के साथ एक बल्ब तथा स्विच के माध्यम से जोड़ देते है ।
4) अब बीकर में तनु HCl डालकर विद्युत धारा प्रवाहित करते है । इसी क्रिया को तनु सल्फ्यूरिक अम्ल के साथ दोहराते है ।
5) इन परीक्षणों को ग्लूकोज एवं ऐल्कोहल के विलयनों के साथ अलग-अलग दोहराते है ।
प्रेक्षण एवं परिणाम – हम पाते हैं कि बल्ब प्रत्येक स्थिति में नहीं जलता है । अम्ल (HCl एवं H2SO4 ) की स्थिति में बल्ब जलने लगता है क्योंकि अम्ल विलयन में आयनिकृत हो जाते है और H+ आयन उत्पन्न करते है जिससे विद्युत धारा का चालन होने लगता है ।
जबकि ग्लूकोज एवं ऐल्कोहल, विलयन में आयनिकृत नहीं होते है और H+ आयन उत्पन्न नहीं करते है जिससे विद्युत धारा का चालन नहीं होता है और बल्ब नहीं जलता है ।
प्रश्न-7. आसवित जल विद्युत का चालक क्यों नहीं होता है जबकि वर्षा जल होता है ।
उत्तर- आसवित जल पूर्ण रूप से शुद्ध होता है ,इसमें मुक्त H+ आयन नहीं होते है । अतः यह उदासीन होता है और विद्युत का चालन नहीं करता है । जबकि वर्षा जल में अम्लीय होता है और इसमें मुक्त H+ आयन पाए जाते है अतः यह विद्युत का चालन करता है ।
प्रश्न-8. जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है ।
उत्तर- जल की अनुपस्थिति में कोई भी अम्ल आयनित नहीं होता है । अतः जल की अनुपस्थिति में अम्लों से हाइड्रोजन आयन (H+ ) पृथक नहीं हो पाते । चूँकि हाइड्रोजन आयन ही अम्लों के अम्लीय व्यवहार के लिए उत्तरदायी होते है । अतः जल की अनुपस्थिति में अम्ल , अम्लीय व्यवहार प्रदर्शित नहीं करते है ।




