Allotropes of carbon in Hindi #structure and bonding in diamond, graphite and fullerene
कार्बन के अपररूप – कार्बन के क्रिस्टलीय और अक्रिस्टलीय दोनों ही अपररूप होते हैं । हीरा तथा ग्रेफाइट कार्बन के दो प्रमुख क्रिस्टलीय रूप हैं । H.W. Kroto, E. Smalley और R.F. Curl ने सन् 1985 में कार्बन के एक अन्य रूप फुलरीन की खोज की । इस खोज के कारण इन्हें सन् 1996 में नोबेल पुरस्कार प्रदान किया गया ।
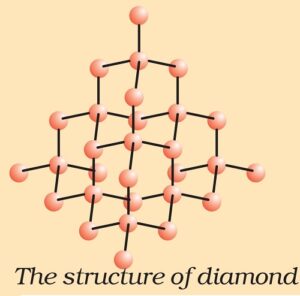
1. हीरा (The structure of Diamond) –
हीरे में प्रत्येक कार्बन परमाणु sp3 संकरित होता है तथा चतुष्फलकीय ज्यामिति से अन्य चार कार्बन परमाणुओं से जुड़ा रहता है । हीरे में मजबूत C-C सहसंयोजन बंधयुक्त त्रिविमीय संरचना होती है ,जिसे तोड़ना काफी कठिन होता है । अतः इसका गलनांक उच्च होता है । हीरा अब तक का ज्ञात सर्बाधिक कठोर पदार्थ है ।
इसका उपयोग धार तेज करने के लिए अपघर्षक (Abrasive) के रूप में, रूपदा (Dies) बनाने में तथा विद्युत-प्रकाश लैम्प में टंगस्टन तंतु (Filament) बनाने में होता है ।
2. ग्रेफाइट (The structure of Graphite) – ग्रेफाइट की परतीय संरचना (Layered structure) होती है । ये परतें आपस में वान्डरवाल बल द्वारा जुड़ी रहती हैं । दो परतों के मध्य की दूरी 340 pm होती है । प्रत्येक परत में कार्बन परमाणु षट्कोणीय वलय (Hexagonal rings) के रूप में व्यवस्थित होते हैं । षट्कोणीय वलय में प्रत्येक कार्बन परमाणु sp2 संकरित होता है । प्रत्येक कार्बन परमाणु तीन निकटवर्ती कार्बन परमाणुओं से तीन सिग्मा बंध बनाता है । इसका चौथा इलेक्ट्रॉन द्विआबंध (p-बंध) बनाता है । जिससे कार्बन की संयोजकता पूर्ण हो जाती है ।
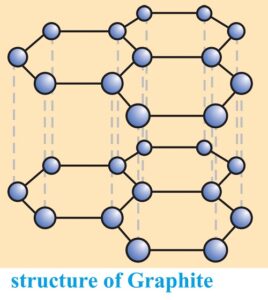
षट्कोणीय संरचना के कारण इसमें कार्बन परमाणुओं के बीच की दूरी अधिक होती है । परतों के मध्य इस दूरी के कारण विपरीत परतों में स्थित कार्बन परमाणुओं के बीच सहसंयोजक बंधों के बनने की संभावना समाप्त हो जाती है । और चौथा संयोजक इलेक्ट्रॉन स्वतंत्र छूट जाता है । इस कारण ग्रेफाइट में इलेक्ट्रॉन का प्रवाह आसानी हो जाता है और ग्रेफाइट विद्युत का सुचालक होता है । ग्रेफाइट को परतों के तल में आसानी से तोड़ा जा सकता है । यही कारण है कि ग्रेफाइट मुलायम (soft) तथा चिकना (slippery) होता है । उच्च ताप पर जिन मशीनों में तेल का प्रयोग स्नेहक (lubricant) के रूप में नहीं हो सकता है ,उनमें ग्रेफाइट शुष्क स्नेहक का कार्य करता है ।
3. फुलरीन (The structure of fulerene) – हीलियम, ऑर्गन आदि अक्रिय गैसों की उपस्थिति में जब ग्रेफाइट को विद्युत आर्क (electric arc) में गर्म किया जाता है, तब फुलरीन का निर्माण होता है । इसमें 60 अथवा 70 का कार्बन परमाणुओं वाली फुलरीन संरचना मुख्य हैं । फुलरीन कार्बन का शुद्धतम रूप है क्योंकि फुलरीन में किसी प्रकार का झूलता बंध (dangling bond) नहीं होता है । फुलरीन की संरचना पिंजरानुमा होती है । C60 अणु की आकृति सॉकर बॉल के समान होती है । इसे बकमिन्स्टर फुलरीन (Buckminster fulerene) अथवा बकी बॉल (Bucky ball) भी कहते हैं ।
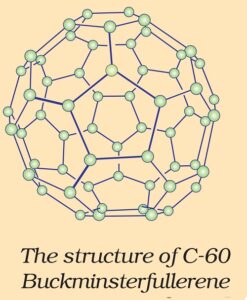
इसमें छः सदस्यीय बीस वलय तथा पाँच सदस्यीय बारह वलय होती हैं । एक छः सदस्यीय वलय छः अथवा पाँच सदस्यीय वलय के साथ संगलित (fused) रहती है ,जबकि पाँच सदस्यीय वलय केवल छः सदस्यीय वलय के साथ संगलित रहती है । सभी कार्बन परमाणु समान होते हैं तथा sp2 संकरित होते हैं । प्रत्येक कार्बन परमाणु अन्य तीन कार्बन परमाणुओं के साथ तीन आबंध बनाता है । चौथा इलेक्ट्रॉन पूरे अणु पर विस्थानीकृत रहता है, जो अणु को ऐरोमैटिक गुण प्रदान करता है ।